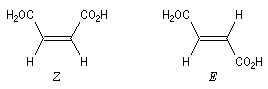
Cours de chimie Organique - G. Dupuis - Lycée Faidherbe Lille
Diastéréo-isomérie
La configuration d'une entité moléculaire est la disposition spatiale des atomes ou des groupes d'atomes de cette entité. Ce terme est propre aux stéréo-isomères dont l'isomérie n'est pas due à des différences de conformation.
Des diastéréo-isomères sont, par définition, des stéréoisomères de configuration non énantiomères.
Diastéréo-isomérie due à la présence d'une double liaison
Les configurations relatives autour d'une double liaison sont nommées en utilisant les stéréodescripteurs Z, E obtenus à partir des règles de Cahn, Ingold et Prelog [1].Double liaison carbone-carbone
La présence d'une liaison double entre deux atomes de carbone empêche la rotation des groupes autour de l'axe de la liaison à la température ordinaire. Les acides (Z)-but-2-ène-1,4-dioïque et (E)-but-2-ène-1,4-dioïque sont des diastéréo-isomères.
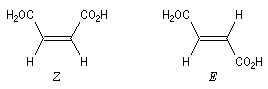
| L'acide (E)-but-2-ène-1,4-dioïque ou fumarique existe à l'état naturel dans certains végétaux (fumaria). On rencontre ses sels dans plusieurs cycles biochimiques importants. Son hydratation en acide L-malique sous l'action de l'enzyme fumarase constitue l'une des étapes du cycle de Krebs. On rouve également ce composé dans le cycle de l'acide citrique et celui de l'urée. |
| L'acide (Z)-but-2-ène-1,4-dioïque ou maléïque peut être obtenu par isomérisation thermique de l'acide fumarique à une température supérieure à 200 °C. |
Un autre exemple est celui des diastéréo-isomères du but-2-ène.
|
|
Le terme citral désigne deux composés diastéréo-isomères : le géranial ou citral A (CA) et le néral ou citral B (CB). On les trouve dans la citronelle de l'Inde (lemmon-grass) ainsi que dans les huiles essentielles de citron et d'orange.
|
Double liaison carbone-azote
La même nomenclature s'applique aux composés comportant une liaison double entre un atome de carbone et un atome d'azote notamment les imines et les oximes. Un doublet non liant est classé comme dernier prioritaire.
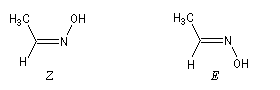
Pour des raisons historiques, les composés de stéréochimie Z sont souvent appelés syn et ceux de stéréochimie E sont appelés anti.
Diastéréo-isomérie due à la présence d'un cycle
Composés monocycliques
Le plan de référence est le plan moyen du cycle. Lorsque les substituants de plus grande priorité sont du même côté de ce plan moyen, le composé est de stéréochimie Z ou cis. Lorsque ces substituants sont situés de part et d'autre de ce plan, le composé est de stéréochimie E ou trans.
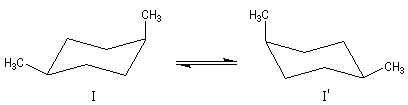
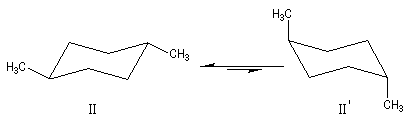
Les molécules précédentes possèdent un plan de symétrie qui coupe le cycle en passant par les groupes méthyle. Elles ne sont donc pas chirales.
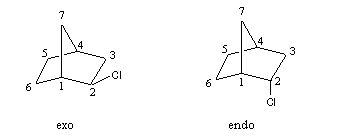
Remarque : on trouve, par exemple, ce type de composés dans la chimie des dérivés du camphre.
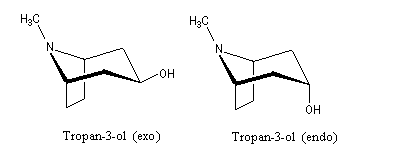
Les composés peuvent exister sous deux formes énantiomères ou bien être des composés méso comme dans l'exemple du tropan-3-ol, obtenu par hydrolyse de l'atropine.
Remarque : un moyen classique de synthèse des composés bicycliques est la réaction de Diels-Alder. Voir par exemple la synthèse du patchoulol.
Diastéréo-isomérie due à la présence de plusieurs centres chiraux
Absence de cycle|
(2R, 3R)-2-bromo-3-fluorobutane |
(2S, 3S)-2-bromo-3-fluorobutane |
|
(2R, 3S)-2-bromo-3-fluorobutane |
(2S, 3R)-2-bromo-3-fluorobutane |
Le schéma ci-dessous précise les relations d'énantiomérie, symbolisées par E et de diastéréo-isomérie, symbolisées par D.
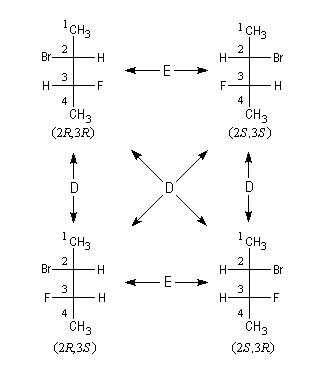
Lorsque deux atomes de carbone asymétriques sont substitués par des groupes identiques, le nombre de stéréoisomères diminue car le nombre d'arrangements possible est plus petit.
Il n'existe que trois stéréoisomères de la famille des acides 2, 3-dihydroxybutanedioïque (acides tartriques) :Dans la chimie des sucres, le décompte des stéréoisomères peut être facilité en utilisant la projection de Fischer.
EpimèresLa testostérone (I) et l'épitestostérone (II) sont des stéroïdes épimères qui ne diffèrent l'un de l'autre que par la configuration de l'atome de carbone portant le groupe OH.
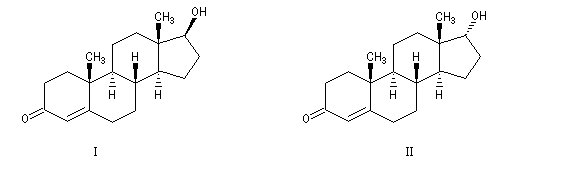
Dans l'organisme humain, le rapport I/II entre ces deux diastéréo-isomères est d'environ 1. L'administration de testostérone exogène chez un sportif, se traduit par une augmentation de ce rapport car la quantité d'épitestostérone n'est pas modifiée. L'élévation anormale du rapport I/II traduit donc un dopage.
L'épimérisation est un phénomène dynamique qui peut, ou non, s'accompagner d'une variation du pouvoir rotatoire, selon que les diastéréo-isomères sont, ou non, chiraux.
Présence d'un cycle
Nous allons examiner le cas des stéréo-isomères du (1,2)-diméthylcyclohexane. La molécule de cis-(1,2)-diméthylcyclohexane est a priori chirale. En effet si on la regarde comme une structure figée, elle n'est pas superposable à son image dans un miroir plan.
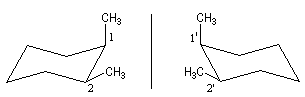
Cependant, à la température ordinaire, le basculement conformationnel égalise les populations des deux énantiomères.
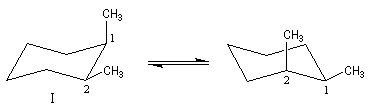
Les molécules dessinées à droite sont identiques (amener 1 en coïncidence avec 2' et 2 en coïncidence avec 1'). Le cis-(1,2)-diméthylcyclohexane est un composé méso. Il s'agit du (1R, 2S)-1,2-diméthylcyclohexane.
Il existe d'ailleurs des conformations achirales de ce composé. Cela apparaît plus nettement en utilisant la représentation de Cram (I') de ce composé (plan de symétrie passant entre les atomes 1 et 2.)
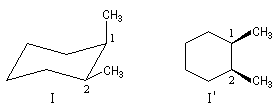
|
La molécule de cis-(1,2)-diméthylcyclohexane considérée comme une structure figée, est chirale. A la température ordinaire les deux énantiomères sont en équilibre rapide et un échantillon à l'échelle macroscopique du du composé est constitué d'un mélange racémique de molécules énantiomères. |
Les dessins ci-dessous représentent le (1S, 2S)-1,2-diméthylcyclohexane (figure I) et son énantiomère le (1R, 2R)-1,2-diméthylcyclohexane (figure II) en utilisant successivement la représentation en perspective et la représentation de Cram.
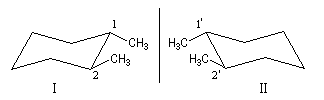
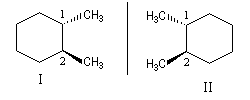
Le basculement conformationnel ne permet pas de passer d'un énantiomère à l'autre.
| Il existe deux énantiomères de la molécule de trans-(1,2)-diméthylcyclohexane. Ces sont les énantiomères (1R, 2R) et (1S, 2S). |
Le composé cis et le composé trans (S, S) sont des diastéréo-isomères. De même le composé cis et le composé trans (R, R) sont également diastéréo-isomères.
Un problème un peu plus compliqué mais assez proche dans son principe du précédent est celui de l'étude des décalines cis et trans.
Généralisation
Dans une molécule possédant n atomes de carbone asymétriques, on s'attend à un nombre maximum de stéréoisomères de 2n. Ce nombre ne tient pas compte des isoméries supplémentaires dues à d'autres causes comme l'existence de doubles liaisons. Le nombre de stéréoisomères croit donc très vite avec n.
Le menthol possède 3 atomes de carbone asymétriques. Il y a 23 = 8 stéréoisomères.
Il existe de même 24 = 16 stéréoisomères possédant la même formule développée plane que le glucose naturel (aldohexoses avec quatre atomes de carbone asymétriques.)
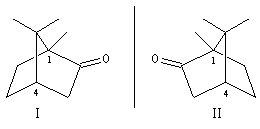
Dans certains cas, le nombre de stéréoisomères est inférieur au nombre total possible. Cela peut venir du fait que certaines molécules sont achirales. C'est le cas de composés méso comme l'acide mésotartrique. Il se peut aussi que certaines configurations soient rendues impossibles du fait de la rigidité d'un système ponté. Un exemple est celui de la molécule de camphre qui possède deux atomes de carbone asymétriques (les atomes 1 et 4) mais qui ne présente que deux stéréoisomères : la molécule de camphre naturel (II) et son énantiomère (I).
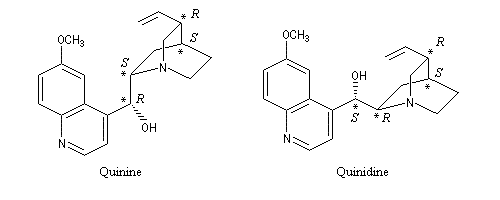
De même, la molécule de quinine ayant quatre centres chiraux, on peut prévoir au maximum 16 stéréoisomères. Mais, du fait de la présence d'un système ponté, il n'en existe que huit. La figure ci-dessous représente la quinine et l'un de ses diastéréo-isomères : la quinidine. Il y en a deux autres : la cinchonine et la cinchonidine. Ces molécules étant chirales, elles ont à chaque fois un énantiomère. Il y a donc bien 16 stéréo-isomères.
Ces alcaloïdes sont présents à l'état naturel dans l'écorce de quinquina.
Le cholestérol appartient à la famille des stéroïdes. La molécule est représentée successivement en perspective puis en utilisant la représentation de Cram.
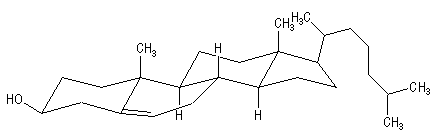
Il y a huit atomes de carbone asymétriques : C3, C8, C9, C10, C13, C14, C17, C20.
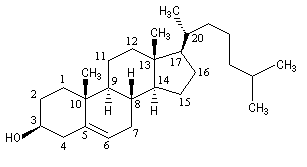
|
Le cholestérol est le représentant le plus connu d'une famille de composés naturels très répandus dans le règne animal et végétal : les stéroïdes .
La molécule possède 8 atomes de carbone asymétriques. On peut donc prévoir 256 stéréoisomères au maximum pour cette molécule. Seul le composé dessiné à gauche existe à l'état naturel.
Le chimiste allemand Adolf Windaus a reçu le prix Nobel de chimie en 1928, pour ses travaux concernant les stérols. Cependant, la structure qu'il proposa pour le cholestérol était inexacte. La structure correcte de la molécule a été établie à la suite des travaux de J. D. Bernal relatifs à un dérivé du cholestérol : l'ergostérol (1932). |
Propriétés des diastéréo-isomères
Propriétés physiques
Au sein de deux diastéréo-isomères, les distances interatomiques n'étant pas les mêmes, les propriétés physiques seront donc en général différentes.
C'est la raison pour laquelle les propriétés physiques et chimiques des acides (Z) et (E)-but-2-ène-1,4-dioïques avaient paru suffisamment éloignées l'une de l'autre aux chimistes du 19ème siècle, pour qu'ils leurs donnent des noms différents.
|
Isomère |
Nom du composé |
TF (°C) |
|
Z |
maléique |
131 |
|
E |
fumarique |
287 |
Le cas des stéréoisomères de l'acide tartrique est également significatif.
|
Composé |
[a ] (°. dm-1.g-1.cm3) |
TF (°C) |
Densité d |
|
(-)-(2S, 3S) |
-12 |
170 |
1,76 |
|
(+)-(2R, 3R) |
+12 |
170 |
1,76 |
|
(2R, 3S) |
0 |
140 |
1,67 |
Propriétés chimiques
Des molécules ayant des groupes caractéristiques identiques dont les positions dans l'espace ne sont pas les mêmes, auront des propriétés chimiques différentes :
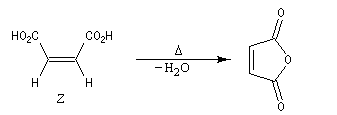
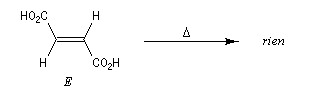
La jasmone, une cyclopentanone extraite du jasmin, possède une chaîne latérale de stéréochimie Z. Son diastéréo-isomère ne possède pas la même odeur.
Spectroscopie
Spectroscopie ultraviolette
En spectroscopie UV-visible, la longueur d'onde du maximum d'absorption et le coefficient d'absorbance sont très sensibles à l'orientation autour de la double liaison dans les systèmes conjugués comme le montre l'exemple du (Z)-diphényl-1,1-éthène et du (E)-diphényl-1,1-éthène.
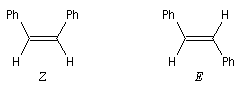
La conjugaison est moins importante dans l'isomère Z car l'interaction entre les cycles aromatiques empêche qu'ils soient coplanaires.
|
Composé |
Z |
E |
|
l (nm) |
280 |
296 |
|
e |
10 500 |
29 000 |
Ces résultats ont été généralisés sous forme règles par Woodward et Fieser. Elles permettent de contribuer à la prévision de la stéréochimie de structures complexes.
Spectroscopie de RMN
La constante de couplage 3JHH entre deux protons vicinaux dépend de leur configuration relative.
|
Composé |
Z |
E |
|
3JHH |
10 Hz |
16 Hz |
La molécule de (cis)-1-chloro-2-cyanoéthène constitue un exemple.
La stéréochimie des jonctions de cycle peut parfois être précisée grâce à la présence ou à l'absence d'effet Overhauser nucléaire (nOe).
Chimie de la vision
La vitamine A, ou rétinol est le composé parent des rétinoïdes.
|
Le rétinol est formé dans l'organisme par coupure de la provitamine A ou b-carotène. Le rétinol est le précurseur biochimique d'une molécule importante dans la chimie de la vision : le rétinal, représenté à gauche. Son transport dans l'organisme est
assuré par une proteine appelée 1 RBP. La carence en vitamine A se traduit par des troubles oculaires. |
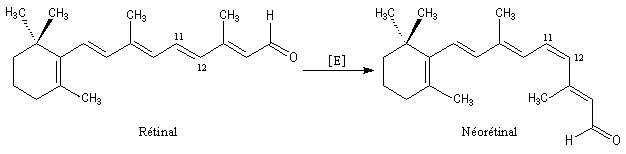
Le rétinal qui possède une stéréochimie E, peut être isomérisé en néorétinal de stéréochimie Z, sous l'action d'une enzyme de la famille des isomérases.
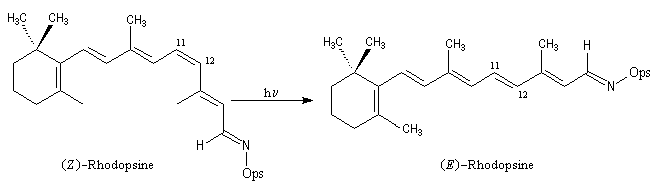
Le néorétinal forme avec une protéine appelée opsine, une imine ou base de Schiff : la (Z)-rhodopsine. Cette dernière est l'un des principaux constituants du pourpre rétinien.
Sous l'action de la lumière, la (Z)-rhodopsine peut s'isomériser en 10-12 s pour donner le diastéréo-isomère (E). Ce dernier qui est instable, évolue en 10-9 s environ pour reformer le rétinal. Cette cascade de réactions est à l'origine de l'influx nerveux transmis au cerveau par le nerf optique [3].
Ouvrages théoriques
J. March - Advanced organic chemistry, Wiley Interscience.
F. A. Carey, R.J. Sundberg - Advanced organic chemistry, 3d edition (Plenum Press, 1990).
E. L. Eliel, S. H. Wilen, Stéréochimie des composés organiques (Tec et Doc).
H. Kagan - La stéréochimie organique (PUF, 1975).
J. L Pierre - Principes de stéréochimie organique statique (A. Colin, 1971).
A. Kirmann, J. Cantacuzène, P. Duhamel - Chimie organique T 1 (A. Colin, 1971).
K. Mislow - Introduction to stereochemistry (W. A Benjamin, New York, 1966).
J. Jacques - La molécule et son double (Hachette, 1992).
V. Pellegrin - Les représentations graphiques bidimensionnelles des molécules en chimie organique (Bulletin de l'Union des Physiciens, février 1999).
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial.
Gérard Dupuis - Lycée Faidherbe - LILLE
juillet 2018