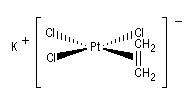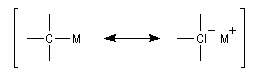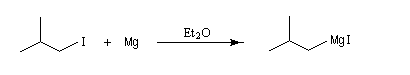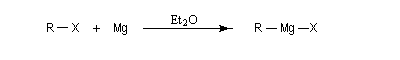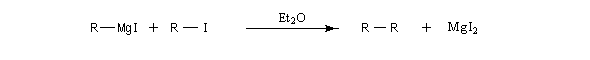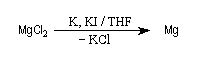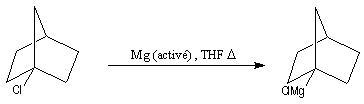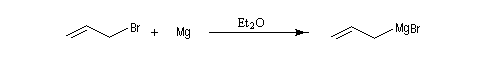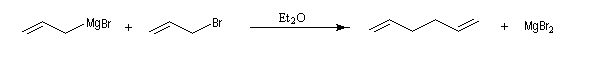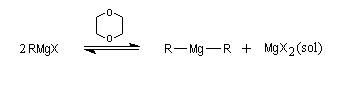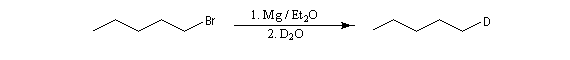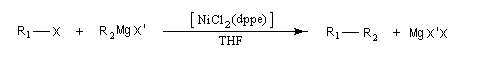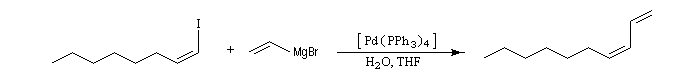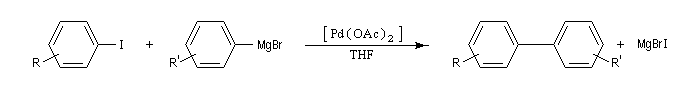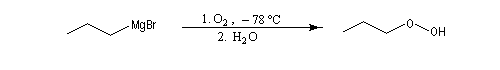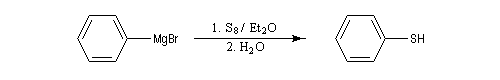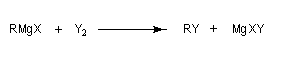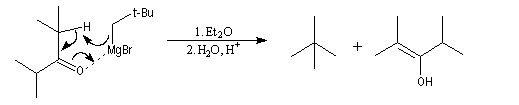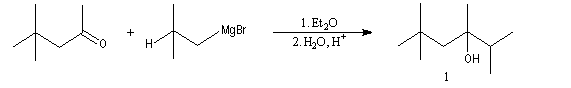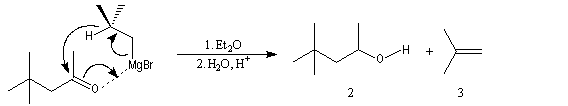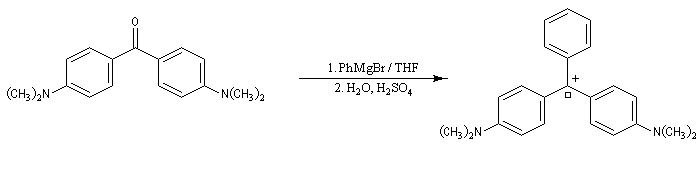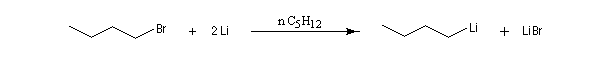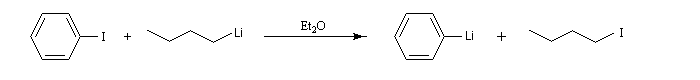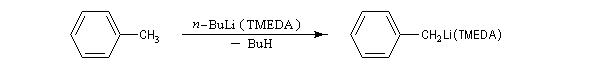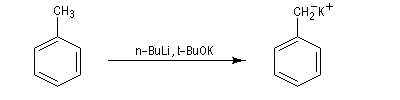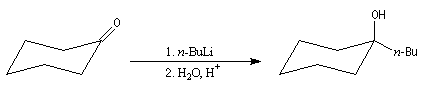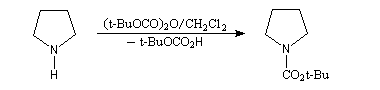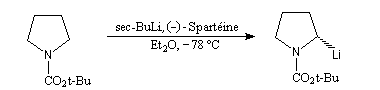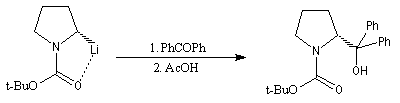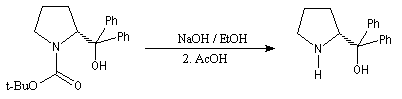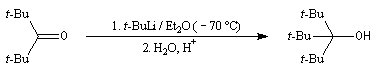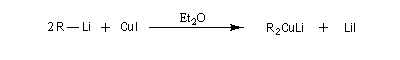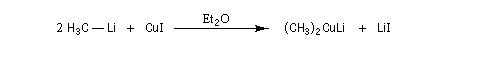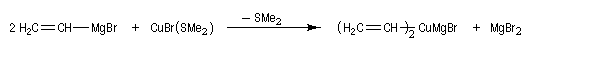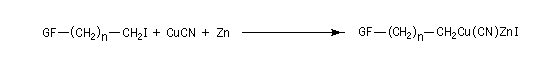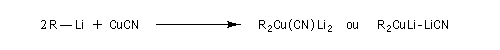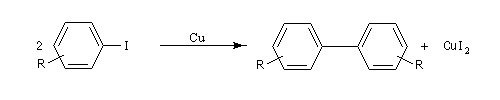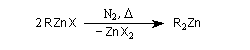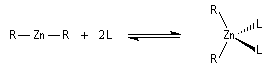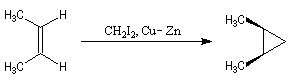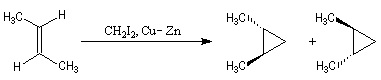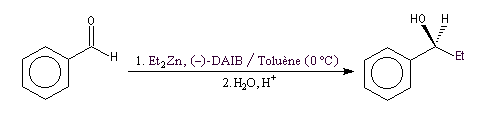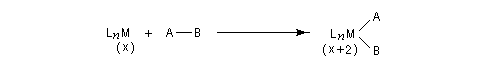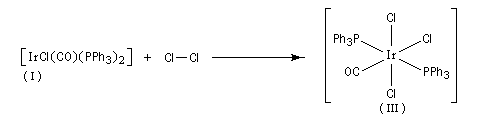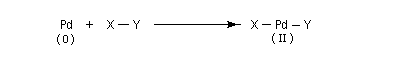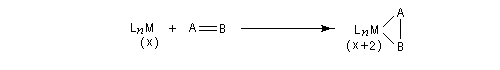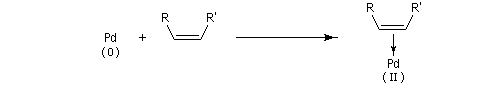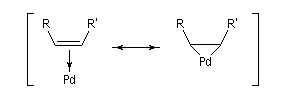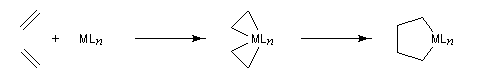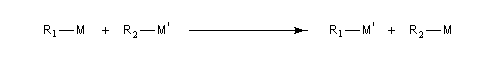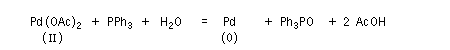Cours de chimie organique - G. Dupuis - Lycée Faidherbe de Lille
Introduction à la chimie des composés organométalliques
Introduction
Origine
Un composé organométallique peut être défini comme un composé dans lequel il existe une liaison métal-carbone.
|
|
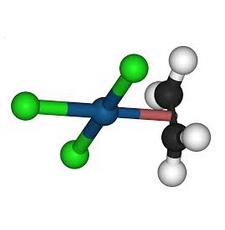
Le premier composé répondant à cette définition est un complexe du platine obtenu par le pharmacien danois W. C. Zeise en 1825. On peut le préparer en faisant barboter de l'éthène dans une solution de tétrachloroplatinate (II) de potassium.
K2PtCl4 + C2H4 = K[Pt h2-(C2H4)Cl3] H2O + KCl
L'analyse au rayons X révèle que le composé éthylénique est perpendiculaire au plan formé par l'atome de platine et les atomes de chlore (voir l'image ci-contre).
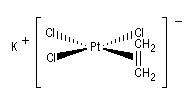
|
On peut interpréter ce résultat comme la formation d'un complexe acide-base de Lewis entre l'acide mou Pt (II) et la base molle C2H4.
Classification des composés organométalliques
Un traitement correct de la liaison métal-carbone utilise la méthode des orbitales moléculaires. Nous utiliserons la classification simplifiée ci-dessous qui utilise un vocabulaire emprunté à la méthode du lien de valence :
- composés s, la liaison entre carbone et métal fait intervenir une ou plusieurs liaisons s. Dans cette catégorie on trouve la plupart des organométalliques les plus classiques, c'est à dire les organolithiens, les organomagnésiens, les organocadmiens etc.
|
Formule |
C2H5MgCl |
PhLi |
(CH3)2 Cd |
(CH3)2CuLi |
|
Nom |
chlorure d'éthylmagnésium |
phényllithium |
diméthylcadmium |
diméthylcuprate de lithium |
Les complexes carbonyles peuvent être mis à profit dans certaines synthèses comme celle du cubane.
- composés p, la liaison entre carbone et métal fait intervenir une ou plusieurs liaisons p. A cette catégorie appartiennent les complexes p-éthyléniques, le ferrocène et les autres métallocènes.
Un autre exemple est constitué par les p-allyl-palladium (II) (h3-allyl PdX ; X = halogène, OAc,
OCOOR,…etc.)
Polarité de la liaison métal-carbone des organométalliques s
Le tableau ci-dessous permet de classer les organométalliques selon le pourcentage de caractère ionique de la liaison C-métal.
|
Elément |
K |
Na |
Li |
Mg |
Al |
Zn |
Cd |
Pb |
Hg |
Cu |
|
Electronégativité |
0,82 |
0,93 |
0,98 |
1,31 |
1,61 |
1,65 |
1,69 |
1,87 |
2,00 |
2,5 |
|
% Caractère ionique |
51 |
47 |
43 |
35 |
22 |
18 |
15 |
12 |
9 |
0 |
Dans tous les cas le carbone porte une charge négative. On peut schématiser la représentation de la liaison entre le carbone et le métal par les formes mésomères suivantes :
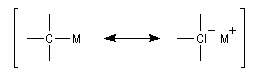
l'importance de la charge négative qui se développe sur l'atome de carbone dépend de l'électronégativité du métal et du solvant. On peut prévoir pour ces composés une réactivité basique et nucléophile.
Si l'on se réfère au dérivé halogéné R-X de départ, la polarité de la liaison entre le carbone et la partie inorganique a été inversée. On dit qu'il y a eu inversion de la polarité de la liaison. Ce concept, convenablement généralisé est souvent mis à profit en synthèse organique. Un exemple est la synthèse de cétones à partir d'aldéhydes par la méthode aux dithianes de Corey et Seebach.
Les composés organosodiques forment de véritables carbanions.
Organomagnésiens
Préparation
Le chimiste français V. Grignard synthétisa en 1901 le premier composé organomagnésien en faisant réagir l'iodure d'isobutyle et le magnésium dans l'éther ordinaire anhydre ou éthoxyéthane [1].
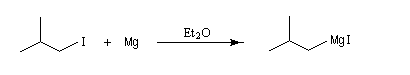
Cette découverte lui valut le prix Nobel de chimie en 1912 conjointement avec P. Sabatier.
Les organomagnésiens iodés, bromés et chlorés sont obtenus la plupart du temps par insertion du magnésium dans la liaison carbone-halogène, en présence d'un solvant donneur d'électrons, le plus souvent un éther comme l'éthoxyéthane ou le THF anhydre.
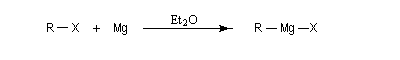
X désigne I, Br, Cl. La synthèse des organomagnésiens fluorés nécessite une procédure spécifique.
|
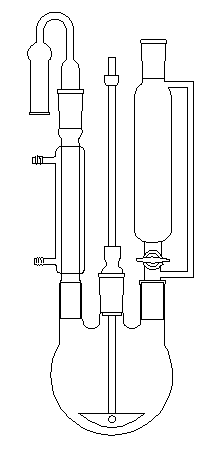
|
Le dessin ci-contre représente un montage classique pour la synthèse d'un composé organomagnésien. Le ballon tricol est surmonté d'un réfrigérant ascendant (à gauche) muni d'un tube desséchant à CaCl2 afin d'éviter l'entrée d'air humide dans le dispositif.
Le dérivé halogéné est introduit par l'ampoule de coulée isobare située à droite. Un agitateur mécanique. (au centre) permet d'améliorer le contact entre les réactifs.
On peut éliminer le risque de réaction secondaire entre l'organomagnésien et l'oxygène de l'air en effectuant un balayage du dispositif par un gaz inerte comme N2.
Dans ce cas, le gaz inerte est introduit par le haut de l'ampoule de coulée. Le tube à CaCl2 n'est plus nécessaire. |
|

|
La photographie représente la mise en œuvre du schéma précédent dans un montage pratique.
L'ensemble du dispositif est surélevé par rapport à la paillasse de façon à pouvoir intervenir sous le ballon. Les différents éléments sont fixés au support vertical à l'aide de pinces. Le tube qui surmonte le réfrigérant contient du chlorure de calcium.
Le support élévateur permet de placer un bain-marie pour augmenter la température du ballon en début de réaction. On peut, si c'est nécessaire, le remplacer rapidement par un cristallisoir d'eau froide pour évacuer plus rapidement la chaleur si la réaction devient trop rapide.
Pour cette synthèse du magnésien du bromoéthane j'ai utilisé de l'éther séché sur de petits morceaux de sodium.
Avec un dérivé bromé primaire comme le bromoéthane la réaction s'effectue très facilement si les différents réactifs sont bien secs. Au bout de quelques minutes l'ébullition de l'éther devient vigoureuse. On peut évacuer la chaleur avec un bain d'eau froide afin de diminuer la vitesse de réaction. L'éthoxyéthane est très volatil, très inflammable et sa vapeur est plus dense que l'air. Il est prudent de travailler avec de faibles quantités et de proscrire tout appareil générant des étincelles et bien sûr toute flamme. |
Le magnésium en tournures, conservé à l'étuve, est introduit dans le ballon puis immédiatement recouvert d'éther anhydre. Une petite quantité du dérivé halogéné contenu dans l'ampoule est introduit dans le ballon. Après une courte période d'induction, la réaction démarre. De petites bulles traduisent l'ébullition du solvant.
On peut accroître la vitesse de départ en élevant la température avec un bain-marie. La réaction étant exothermique elle est rapidement auto-entretenue à la température de reflux du solvant.
Lorsque la réaction a démarré, le dérivé halogéné introduit goutte à goutte à partir de l'ampoule de coulée.
|

|
Le magnésium en tournures, conservé à l'étuve, est introduit dans le ballon puis immédiatement recouvert d'éther anhydre. Une petite quantité du dérivé halogéné contenu dans l'ampoule est introduit dans le ballon. Après une courte période d'induction, la réaction démarre. De petites bulles traduisent l'ébullition du solvant (voir la photo de gauche).
On peut accroître la vitesse de départ en élevant la température avec un bain-marie. La réaction étant exothermique elle est rapidement auto-entretenue à la température de reflux du solvant.
|
Lorsque la réaction a démarré, le dérivé halogéné introduit goutte à goutte à partir de l'ampoule de coulée.
La réaction entre l'organométallique et le substrat qui a servi à le préparer est souvent une réaction indésirable appartenant à la même catégorie que la réaction de couplage de Wurtz.
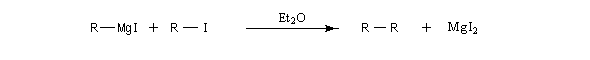
Lors de la préparation des organolithiens et des organomagnésiens, on limite cette réaction parasite en ajoutant le dérivé halogéné goutte à goutte et en travaillant le métal en excès.
Le magnésium disparaît complètement en fin de réaction si les réactifs ont été introduits en proportions stœchiométriques. Avec du magnésium ultra pur, la solution est incolore. Le plus souvent on obtient un mélange gris foncé à cause des impuretés du métal.
La réactivité des halogénures d'alkyles décroît dans le même ordre que la mobilité de la liaison carbone-halogène.
RI > RBr > RCl >> RF
Les bromures d'alkyle ont une réactivité un peu plus faible que celle des iodures. On préfère généralement utiliser les bromures en raison de leur coût moins élevé sauf dans le cas de CH3I qui présente l'avantage d'être le seul dérivé méthylé liquide à la température ordinaire.
L'ajout de quelques gouttes de dibromoéthane permet quelquefois de décaper le magnésium. Il s'agit d'une réaction d'élimination intramoléculaire.
R. D Rieke et S. E. Bales ont mis au point en 1974 une méthode de préparation de magnésium en poudre, très réactif par réduction de MgCl2 avec un métal alcalin en présence de KI [3].
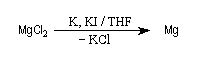
Avec ce type de magnésium, la préparation des organomagnésiens difficiles à préparer est possible par union directe du magnésium et d'un halogénoalcane. Cette procédure est généralisable à d'autres métaux.
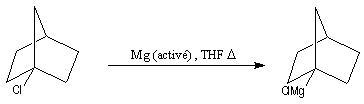
On peut ainsi préparer des magnésiens à partir de fluorures d'alkyles.
La préparation des magnésiens vinyliques, par insertion du métal dans la liaison carbone-halogène faiblement réactive, s'effectue dans un éther plus solvatant que l'éthoxyéthane, le THF anhydre.

L'utilisation des magnésiens vinyliques dans le THF anhydre a été largement développée par le chimiste français H. Normant dans les années 60.
Les organomagnésiens alcyniques sont préparés par réaction entre un organomagnésien et un alcyne terminal.
Le caractère fortement réducteur du magnésium rend impraticable la préparation d'organomagnésiens fonctionnalisés par réaction entre un dérivé halogéné et le métal. Les magnésiens aromatiques portant des groupes fonctionnels comme le groupe ester peuvent être préparés avec succès grâce à une réaction d'échange métal-halogène dans des conditions très douces.

Ce type de composé réagit avec des substrats électrophiles comme les aldéhydes.
Organomagnésiens allyliques
Les organomagnésiens de type allylique sont préparés assez facilement car la liaison métal-halogène des composés allyliques est très réactive.
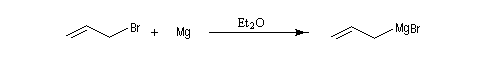
Les magnésiens allyliques déplacent facilement l'halogène du substrat car ces composés donnent facilement un carbocation allylique. C'est la raison pour laquelle on doit utiliser des solutions diluées d'halogénure et le métal en grand excès pour préparer ces organométalliques.
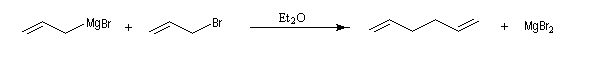
Ce type de réaction peut constituer une méthode de synthèse de diènes 1,5.
Structure, rôle de la base de Lewis
Les organomagnésiens et les organolithiens ont un atome métallique électrophile. Ce sont des acides de Lewis. La base de Lewis constituée par un composé donneur d'électrons va interagir avec l'organométallique et le stabiliser. Les éthers sont parmi les composés les plus couramment utilisés mais on peut aussi utiliser des amines tertiaires comme la triéthylamine. Mais lorsque la basicité de Lewis du composé croit, la réactivité de l'organométallique diminue.
Structure à l'état solide
La plupart du temps, les magnésiens sont utilisés immédiatement après avoir été synthétisés. On peut toutefois les conserver à l'état sec, à l'abri de l'humidité et de l'air. Il faut faire attention que même à sec, il reste des molécules d'éther complexées avec l'organomagnésien et ce complexe peut s'enflammer spontanément dans l'air.
Avec les éthers, on a pu mettre dans certains cas en évidence à l'état solide, la présence de deux molécules d'éther par molécule d'organométallique.
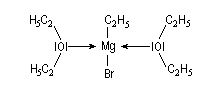
Il existe des structures plus complexes qui font intervenir deux molécules d'organomagnésien.
|
|
La structure d'un certain nombre de composés organomagnésiens à l'état solide a été déterminée par diffraction des rayons X.
Dans [EtMgBr(OEt2)2] le magnésium est au centre d'un tétraèdre irrégulier. Sur l'image de gauche l'atome de magnésium est représenté en rose, celui de brome en marron. Les atomes d'oxygène sont en rouge. |
Structure en solution
En solution, la situation est plus compliquée. Plusieurs équilibres interviennent simultanément et leur position dépend de plusieurs facteurs (concentration, température, solvant, etc.)
On peut mettre en évidence un équilibre entre magnésien mixte et symétrique, appelé équilibre de Schlenk. Dans le dioxane cet équilibre est déplacé en faveur du magnésien symétrique car dans ce solvant, MgX2 qui est peu soluble, précipite.
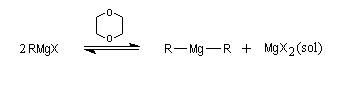
Le déplacement de l'équilibre de Schlenk dans le dioxane favorise les réactions de réduction des cétones dans le cas de magnésiens encombrés possèdant un atome d'hydrogène sur le carbone situé en b du magnésium.
Le choix du solvant dépend notamment de la réactivité de l'halogénure. Avec les dérivés halogénés ordinaires, on utilise le plus souvent l'éther ordinaire ou éthoxyéthane.
Dans le THF, les doublets de l'oxygène sont davantage dégagés stériquement que dans l'éthoxyéthane. Cet éther est ainsi plus solvatant que le précédent. Comme sa température d'ébullition est aussi plus élevée, il permet la synthèse d'organomagnésiens à partir de substrats peu réactifs comme les composés vinyliques. La préparation du THF anhydre est vue dans le chapitre relatif aux éthers.
Le caractère d'acide de Lewis des organomagnésiens se manifeste par la formation de structures chélatées avec certains composés oxygénés. C'est le cas par exemple avec les composés carbonylés substitués en a par un groupe alkoxy. Ces structures chélatées jouent un rôle important dans le déroulement stéréochimique des réactions des organomagnésiens sur ces composés.
Mécanisme de formation des organomagnésiens
Bien qu'il ait fait l'objet d'un nombre très important d'études, le mécanisme de formation des organomagnésiens n'est pas connu avec certitude. Globalement il y a eu insertion de magnésium dans la liaison carbone-halogène. Il s'agit donc d'une addition oxydante.
Il est vraisemblable que le mécanisme implique une réaction en chaîne avec intervention de radicaux.
La liaison C- Mg possède un caractère ionique de 35 %. Cela confère aux réactifs de Grignard une position centrale dans la famille des organométalliques.
Basicité
Sont déprotonés de façon quantitative les fonctions suivantes : acides carboxyliques, phénols, alcools, amines, amides non substitués, alcynes terminaux. Lorsqu'un orgnomagnésien réagit sur un substrat porteur de l'une de ces fonctions, celle-ci doit
être protégée. Il existe une grande variété de groupes protecteurs. A titre d'exemple, la fonction alcool peut être protégée par réaction avec un éther d'énol tel que le DHP.
La réaction entre un organomagnésien et un alcyne terminal est à la base de la préparation des magnésiens alcyniques. Certains atomes d'hydrogène acides portés par des atomes de carbone en a de fonctions carbonyles peuvent aussi être arrachés, notamment dans le cas des composés dicarbonylés qui possèdent des atomes d'hydrogène d'acidité notable. Les solvants très solvatants comme l'hexaméthylphosphotriamide (HMPT) favorisent l'énolisation des composés carbonylés.
Avec les magnésiens l'équation s'écrit :
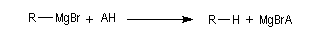
les magnésiens étant fortement basiques, l'hydrolyse conduit à la formation de Mg(OH)2 (s) qui se présente sous la forme d'un solide blanc :
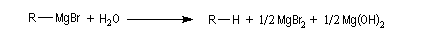
la réaction avec l'eau s'écrit souvent de façon simplifiée :
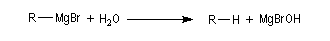
Afin d'éviter la précipitation de Mg(OH)2 , on réalise le plus souvent l'hydrolyse des magnésiens en milieu acide avec une solution de NH4Cl ou d'acide sulfurique dilué.
Ces réactions constituent le plus souvent une limitation à l'emploi des organomagnésiens. On peut aussi les mettre à profit dans quelques cas particuliers.
Dosage des organomagnésiens & des organolithiens
La réaction entre un organomagnésien ou un organolithien et un alcool comme le butanol est quantitative. Cette réaction peut être donc mise à profit pour effectuer le dosage de l'organométallique.
|
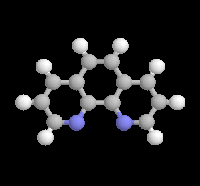
|
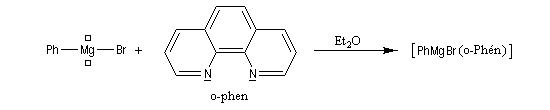
L'orthophénantroline-1,10 (image de gauche) et la bisquinoléine jouent, grâce à leurs atomes d'azote, le rôle de base de Lewis vis à vis du métal électrophile des magnésiens et des lithiens.
Ces composés forment des complexes de transfert de charge colorés avec ces organométalliques : le bromure de phénylmagnésium dans l'éther donne un complexe de couleur rose saumon, le butyllithium dans le toluène donne un complexe de couleur rouge. |
|

|
La photographie de gauche représente une expérience destinée à mettre en évidence le rôle de l'orthophénantroline comme indicateur dans le dosage des organomagnésiens et des organolithiens.
L'ajout d'une petite quantité de bromure de phénylmagnésium à une solution d'orthophénantroline dans l'éther fournit une coloration rose saumon. Cette coloration est due à la formation d'un complexe de transfert de charge entre l'orthophénantroline qui joue le rôle de donneur d'électrons et l'organomagnésien qui joue le rôle d'accepteur d'électrons. |
Dans la méthode de S. C. Watson et J. F. Eastham, on ajoute progressivement avec une burette, une solution dans le xylène de butan-2-ol de concentration connue, dans la solution d'organométallique à doser. On ajoute à cette dernière, une petite quantité d'orthophénantroline ou de bisquinoléine. A l'équivalence, l'organomagnésien est complètement consommé ce qui se traduit par la disparition de la couleur de la solution d'organométallique [30].
La méthode dite de Zérévitinov est assez ancienne. L'organomagnésien est mis à réagir avec une solution de concentration connue d'un composé à hydrogène mobile dissous dans un solvant inerte. On obtient un alcane dont on mesure le volume. Inversement, avec une solution titrée d'organomagnésien, on peut doser des composés à hydrogène mobile. Une réaction du même type, permet l'introduction de deutérium en utilisant de l'eau lourde.
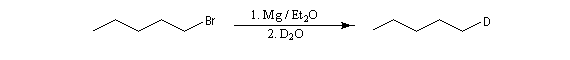
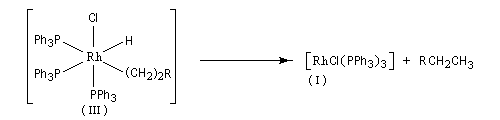
Réaction de couplage croisé de Kumada
Cette réaction introduite par le chimiste japonais Kumada en 1972 constitue l'un des premiers exemples de réaction de couplage croisé [35]. Les partenaires sont un organomagnésien et un dérivé halogéné. Elle est catalysée par un complexe du nickel tel que NiCl2(dppe) ; (dppe : diphénylphosphinoéthane) [23].
R1 : alkyle, alcényle, aryle
X : halogène (I, Br) , OTf (triflate) ;
R2 : alkyle, alcényle, aryle
X : halogène (I, Br, Cl)
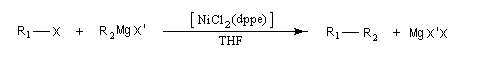
L'avantage de cette réaction réside dans sa simplicité. Le couplage direct de l'organomagnésien évite le passage par un organozincique comme dans la réaction de Negishi.
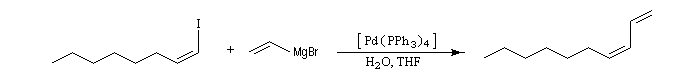
La réaction a été utilisée avec succès pour synthétiser des biaryles non symétriques.
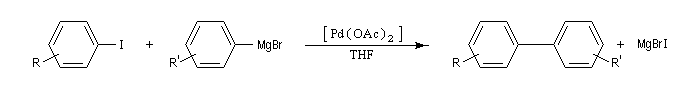
La principale limitation de cette réaction est dûe à l'incompatibilité entre les organomagnésiens et certains groupes fonctionnels.
remarque : le couplage des organomagnésiens avec les dérivés halogénés peut être catalysé par Fe(DBM)3 (DBM = dibenzoyle méthane). Cette réaction est appelée couplage de Kochi [37].
Réactions avec des réactifs inorganiques
Carbonatation des organomagnésiens et des organolithiens
Ces réaction ont été étudiée dans le chapitre sur les dérivés d'acides.
Dioxygène, soufre
La réaction entre un organomagnésien et le dioxygène en excès à basse température (- 78 °C dans le mélange carboglace-acétone) suivie d'hydrolyse, est une très bonne méthode de préparation des hydroperoxydes.
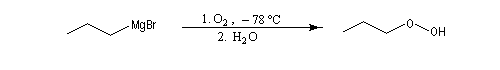
Le contrôle de la température est important dans cette synthèse car les peroxydes organiques sont des composés peu stables en raison de la faible énergie de dissociation de la liaison peroxo qui lie les deux atomes d'oxygène. Ils sont potentiellement explosifs et donc dangereux. Si l'organomagnésien est en excès, il réagit avec le peroxyde d'halogénure magnésium et on obtient l'alcool après hydrolyse. Cette dernière réaction ne possède pas d'intérêt synthétique particulier et constitue une réaction secondaire qui peut être gênante lors de la préparation des organomagnésiens. C'est la raison pour laquelle il est préférable d'effectuer leur synthèse sous atmosphère inerte (Ar ou N2) [16].
Avec le soufre, la réaction s'effectue par union directe entre le magnésien. Après hydrolyse, on obtient un thiol ou un thiophénol.
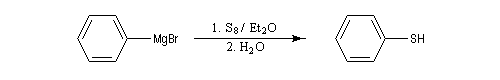
Dihalogènes
On peut regarder cette réaction comme une substitution nucléophile. Dans ce cas R- MgX est le réactif et Y2 est le substrat.
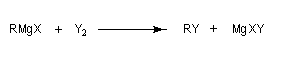
La réaction avec I2 est la plus intéressante. Elle permet la préparation des iodures d'alkyles à partir de leurs analogues chlorés ou bromés. On peut aussi mettre cette réaction à profit dans le dosage des organomagnésiens. I2 est introduit en excès et on effectue le dosage de I2 restant par le thiosulfate. Les cuprates lithiens vinyliques réagissent avec le diiode pour donner des alcènes halogénés [7].
Réactions secondaires des organomagnésiens
Enolisation
Dans le cas de substrats encombrés, l'énolisation du substrat par l'organomagnésien jouant le rôle de base, peut devenir plus rapide que l'addition nucléophile sur le carbonyle.
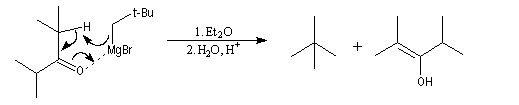
L'énol se tautomérise rapidement pour redonner la cétone de départ. Le pourcentage d'énolisation dépend du solvant utilisé. Dans des solvants très solvatants comme HMPT (hexaméthylphosphotriamide) le pourcentage d'énolisation peut devenir très élevé.
|
|
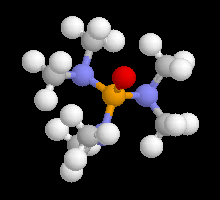
L'hexaméthylphosphotriamide (HMPT) possède une constante diélectrique assez élevée (
er = 30) et surtout .un moment dipolaire très grand (m = 5,5 D). La charge négative est relativement dégagée tandis que la charge positive portée par le phosphore est masquée et dispersée par les substituants (observer le modèle "spacefill"). HMPT possède un pouvoir solvatant important vis à vis des sites déficients en électrons du magnésium et la liaison carbone-métal des magnésiens est fortement polarisée. Dans ce solvant, les magnésiens ont une action énolisante vis à vis des composés carbonylés.
Attention : en anglais HMPT est noté HMPA, sigle qui, en français, désigne un autre composé. |
On peut mettre ces propriétés à profit pour synthétiser des cétones à partir des esters.
Réduction
Cette réaction intervient spécialement lorsque l'organomagnésien possède un atome d'hydrogène sur l'atome de carbone en b.
La réaction entre la 4,4-diméthylpentan-2-one et le bromure de 2-méthyléthylemagnésium suivie d'hydrolyse, fournit trois produits :
A côté de l'alcool tertiaire (1) qui provient de l'addition de l'organomagnésien sur la cétone, on obtient un alcool secondaire (2) et du méthylpropène (3).
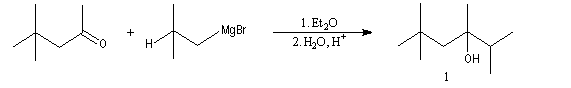
On interprète la formation de (2) et (3) par une réaction de réduction de la cétone impliquant l'addition nucléophile d'un ion hydrure de l'organomagnésien sur le groupe carbonyle.
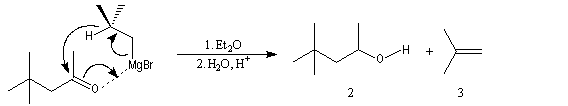
Elle rappelle la réaction de Meerwein, Ponndorf et Verley. Cette réaction est favorisée dans le dioxane qui permet de déplacer l'équilibre de Schlenk vers la formation du magnésien symétrique. Dans ce solvant, R2Mg interagit avec l'oxygène du carbonyle de la cétone et favorise le transfert d'ion hydrure.
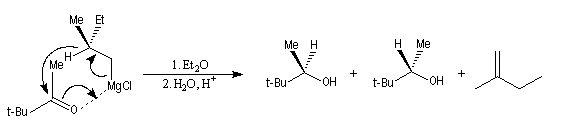
L'utilisation d'organomagnésiens chiraux a permis à H. S. Mosher en 1950, de réaliser la réduction énantiosélective de cétones encombrées [31].
Test des organométalliques
La cétone de Michler (4,4'-bis(diméthylamino)- benzophénone) réagit avec les organomagnésiens pour donner des composés fortement colorés. Le complexe de transfert de charge initial fournit après hydrolyse un alcool. En milieu acide, ce dernier peut conduire à un carbocation tertiaire relativement stable.
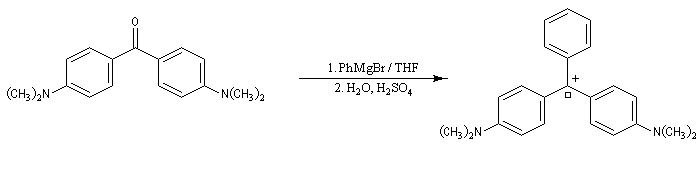
La conjugaison est suffisamment étendue pour que le système absorbe la lumière dans le domaine visible. Le carbocation formé confère à la solution une belle couleur verte.
|

|
L'erlenmeyer contient une solution de bromure de phénylmagnésium dans l'éthoxyéthane. On ajoute successivement 1 mL d'une solution de cétone de Michler dans le toluène, 1 mL d'eau distillée puis quelques gouttes d'acide acétique (éthanoïque). Après agitation, une couleur bleu vert de développe. Le carbocation obtenu est utilisé comme colorant. Celui-ci est appelé vert malachite en raison de la ressemblance de sa couleur avec celle de la malachite CuCO3(OH)2 : un minerai de cuivre (composé avec lequel il n'a bien entendu aucune parenté chimique). Porter des gants pour manipuler ce composé. |
Rappel sur quelques réactions des organomagnésiens en synthèse organique
Organolithiens
Préparation
Les organolithiens les plus simples peuvent être obtenus par réaction entre le métal et un dérivé halogéné. Compte-tenu de la grande réactivité de ces composés il est indispensable d'utiliser des réactifs rigoureusement anhydres et de travailler en l'absence d'oxygène. On utilise un montage du même type que le précédent et on procède à un balayage soigneux du dispositif par un gaz inerte. L'utilisation d'une cuve à ultrasons permet d'accroitre la vitesse de la réaction en provoquant un décapage du métal. Différents solvants peuvent être utilisés parmi lesquels les éthers, le pentane, le cyclohexane.
|

|
Le butyllithium est un réactif très utile qu'on peut préparer par la réaction suivante :
On le trouve dans le commerce, sous forme de solutions de 2 mol.L-1 à 10 mol.L-1 dans le pentane ou l'hexane. On le conserve dans des flacons tels que celui représenté sur la photographie ci-contre muni d'un bouchon de caoutchouc permettant l'introduction d'une aiguille. Il s'enflamme à l'air et réagit très violemment avec l'eau. Il est utilisé en tant que base très forte pour générer des carbanions, des amidures comme le LDA ou à la préparation d'autres organolithiens par métallation de liaisons C-H d'hydrocarbures.
|
Les dérivés aromatiques peuvent être synthétisés par réaction directe mais ils sont obtenus de façon plus pratique par une réaction d'échange métal-halogène beaucoup plus rapide. Le phényllithium, découvert par G. Wittig, peut être préparé par la réaction suivante :
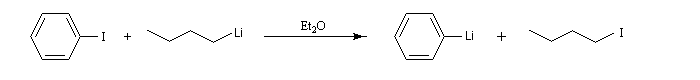
|

|
A la température ordinaire, le tert-butyllithium est un solide de couleur blanche. Il réagit très violemment avec l'eau et il est extrêmement pyrophorique. Son utilisation est malheureusement à l'origine de plusieurs accidents dont celui qui provoqua le décès de Sheri Sangji à UCLA en 2009. (voir : pubs.acs.org dont est extrait la photographie ci-contre.)
t-BuLi est utilisé en solution dans des solvants de type hydrocarbure tels que l'heptane. Il a une basicité encore plus grande que le n-butyllithium (voir plus bas.) Ainsi, il est capable de déprotonner le benzène.
La photographie montre l'extraction d'une solution de t-BuLi dans l'heptane au moyen d'une seringue sous atmosphère inerte. Noter le gant résistant au feu utilisé par l'opérateur. Le petit tube contenant un liquide coloré permet de visualiser les bulles de gaz inerte injecté dans le flacon.
|
Utilisation de cosolvants
Les organolithiens ont tendance former des associations dans les éthers et les hydrocarbures. Dans ces solvants, ils se trouvent sous forme de tétramères, hexamères etc.
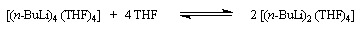
La tétraméthyléthylènediamine (TMEDA) est un agent complexant particulièrement fort du lithium dans ces composés, grâce aux doublets non liants de l'azote. Il est fréquemment utilisé comme cosolvant des organolithiens. En présence de TMEDA, les possibilités d'association diminuent car les sites acides du métal sont complexés. La polarité de la liaison C-Li est considérablement accrue.
Basicité
Puisque ce sont des carbanions potentiels, les organométalliques réagissent avec les composés possédant un atome d'hydrogène mobile. La position de l'équilibre acido-basique dépend de la différence des pKa des couples concernés.
|
Composé |
n-BuLi |
s-BuLi |
t-BuLi |
|
déprotone les hydrocarbures jusqu'à pKa |
46 |
51 |
54 |
La métallation est une réaction acido-basique généralement très efficace sur le plan thermodynamique car les alcanes sont des acides très faibles. Cette réaction n'est rapide que lorsque l'atome d'hydrogène est arraché à partir d'un atome de carbone digonal (substrats acétyléniques). Elle est lente avec les protons portés par des atomes de carbone trigonaux ou tétragonaux. Sa vitesse peut être fortement accrue, même à basse température, par l'utilisation de cosolvants complexants comme la tétraméthyléthylènediamine (TMEDA).
Le complexe butyllithium-(TMEDA), essentiellement sous forme monomère, acquiert une grande basicité et ce complexe est capable de déprotoner des hydrocarbures comme le toluène (pKa = 35).
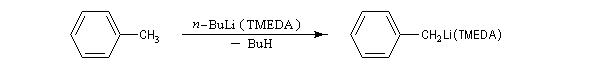
Ce complexe permet également la métallation du ferrocène.
Des exemples d'utilisation du butyllithium en tant que base, concernent la préparation de carbanions stabilisés par des hétéroatomes :
Les réactions de déprotonation par le butyllithium sont particulièrement propres car le sous-produit de la réaction n'est autre que le butane.
Le mélange équimolaire de butyllithium et de tertiobutylate de potassium constitue la base de Schlosser. Il s'agit d'un réactif basique très puissant capable de déprotoner le toluène.
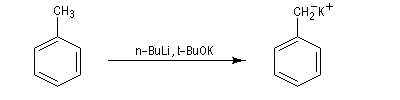
Le butyllithium peut naturellement donner des additions nucléophiles avec les composés insaturés polaires comme les carbonylés. Ce sont des réactions concurrentes quand on cherche seulement à déprotoner ces composés dans le but de former un énolate.
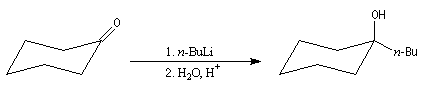
Lors de la réaction entre le n-butyllithium et la cyclohexanone suivie d'hydrolyse, environ 90 % du substrat est transformé en alcool tertiaire. En présence d'un ligand chiral, une telle addition peut être rendue énantiosélective [9].
Une base de choix pour s'affranchir de telles difficultés est le LDA qui combine une grande force et une nucléophilie très faible.
Rappelons que la manipulation des organolithiens comme le butyllithium, nécessite des précautions particulières car ils s'enflamment spontanément à l'air. Le t-butyllithium est particulièrement pyrophorique. On doit impérativement travailler sous atmosphère inerte (Ar, N2) [16].
Pour utiliser les organolithiens dans des conditions optimales quand le solvant est l'éther, il est préférable d'effectuer leur dosage avant réaction car les lithiens attaquent lentement le solvant. L'organométallique provoque une réaction d'élimination en arrachant un d'hydrogène situé sur un atome de carbone en b de l'oxygène.
Déprotonation énantiosélective
La synthèse énantiosélective à partir d'organométalliques chiraux n'est possible que si l'on empêche l'équilibre d'inversion stéréochimique du centre chiral qui est un carbanion potentiel. Le complexe entre la (-)-spartéine, un alcaloïde extrait du lupin blanc, et un organolithien a été utilisé pour effectuer des réactions de déprotonation énantiosélectives. Un exemple est fourni par la préparation de dérivés de la pyrrolidine [10].
On commence par effectuer la protection de la fonction amine par le groupe t-butoxyxarbonyle.
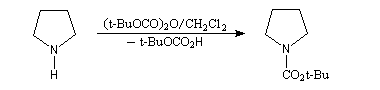
Le butyllithium complexé par la spartéine, arrache sélectivement l'atome d'hydrogène pro-S du substrat.
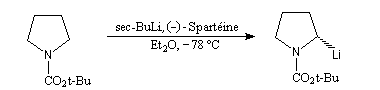
L'interaction entre le lithium et un atome d'oxygène du groupe t-butoxyxarbonyle permet de stabiliser la configuration de l'organolithien.
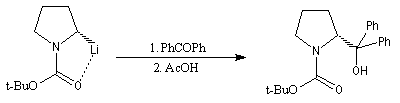
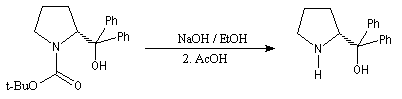
Réaction avec les acides carboxyliques
Les organolithiens sont suffisamment nucléophiles pour donner une réaction d'addition avec les ions carboxylates. Après hydrolyse, on obtient une cétone. Si le substrat est l'acide carboxylique, la réaction d'addition sur le carbonyle est précédée d'une réaction acido-basique qui consomme un équivalent de lithien. Il faut utiliser deux équivalents d'organolithien dans cette synthèse. La préparation de cétones à partir d'acides carboxyliques
est étudiée dans le chapitre correspondant. Les organomagnésiens ne sont pas suffisamment nucléophiles pour donner cette réaction.
Préparation d'alcools encombrés
La synthèse des alcools encombrés peut être réalisée en utilisant des organolithiens. Ceux-ci étant beaucoup plus réactifs que les organomagnésiens, l'addition nucléophile peut être effectuée à basse température (- 70 °C) ce qui minimise les réactions d'énolisation et de réduction observées avec les organomagnésiens.
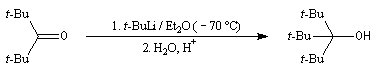
Organocadmiens
Préparation
Ces composés sont généralement préparés par transmétallation entre un organomagnésien et un sel de cadmium ou de zinc.
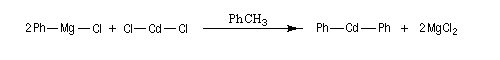
Le magnésium étant moins électronégatif que le cadmium, l'état final dans lequel le magnésium est sous forme de sel et le cadmium dans l'organométallique est plus stable que l'état initial. Les organocadmiens permettent la synthèse de cétones à partir des chlorures d'acyles. Il s'agit d'une méthode relativement ancienne. On utilise plus volontiers de nos jours, la réaction entre un organolithien ou un organomagnésien sur un amide de Weinreb.
Organocuprates
Préparation des organocuprates
Les cuprates lithiens ont été introduits en synthèse organique par le chimiste américain H. Gilman (Iowa State University
) [29]. Il peuvent être préparés à partir d'un organolithien et d'une suspension d'iodure de cuivre (I) dans un solvant aprotique comme l'éthoxyéthane ou le THF à basse température sous atmosphère inerte. On notera que le cuivre porte une charge partielle négative dans ces composés. Ils forment des oligomères (R2CuLi)n.
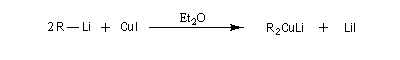
Les dérivés alkylés primaires et secondaires se décomposent à une température supérieure à - 20 °C. (CH3)2CuLi est stable dans l'éther à 0 °C.
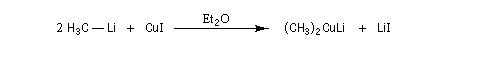
Cu est moins électropositif que le lithium et le magnésium. Aussi, la liaison entre le carbone et le cuivre est moins polarisée qu'avec les métaux précédents.
Les cuprates de Gilman permettent la préparation d'alcanes par couplage avec des dérivés halogénés saturés (réaction de Corey-House-Posner-Whitesides). Avec des substrats allyliques, on obtient des composés éthyléniques substitués.
A la suite des travaux de J. -F. Normant, il est possible de préparer par transmétallation des organocuprates portant un groupe vinyle à partir d'organomagnésiens vinyliques (réactifs de Normant.)
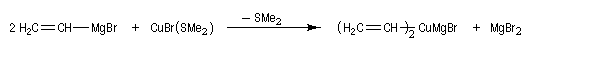
On utilise du bromure de cuivre (I) stabilisé par le diméthylsulfure pour cette réaction.
Les cuprates vinyliques peuvent être préparés par carbocupration entre un cuprate lithien et un alcyne. Ils permettent la préparation d'halogénures vinyliques de stéréochimie déterminée. Leur alkylation par dérivé halogéné permet la synthèse d'alcènes substitués avec une grande stéréosélectivité.
Cuprates zinciques
A la différence des magnésiens ordinaires, les organozinciques sont compatibles avec une grande variété de groupes fonctionnels (GF) tels que : ester, nitrile, amine etc. Malheureusement ils sont peu nucléophiles. Leur emploi est donc assez limité.
L'addition d'une quantité catalytique de CuCN, 2 LiCl permet de passer au cuprate de Knochel beaucoup plus réactif qu'un organozincique ordinaire
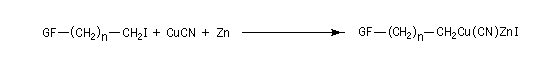
Ces composés réagissent de façon régiosélective en 1, 4 sur les carbonylés a, b-insaturées. Leur grand intérêt réside dans le fait qu'ils sont compatibles avec de nombreux groupes fonctionnels : (cétone, ester, nitrile, amine etc.)
Cuprates de Lipshutz
En ajoutant CuCN à une solution de cuprate de lithium, le chimiste américain Bruce Lipshutz a découvert une nouvelle famille de cuprates de formule générale : RnCu(CN)Lin. Avec : n = 1 (cuprates 1 : 1) ou n = 2 (cuprates 2 : 1). Dans ce dernier cas, ce sont des cuprates d'ordre supérieur (en anglais : higher order cuprates). Leur structure est encore l'objet de controverses. Leur réactivité est plus élevée que celle des cuprates de 1 : 1 [36].
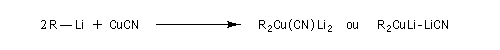
Les cyanocuprates permettent d'effectuer des réactions de substitutions sur des dérivés halogénés secondaires.
Tous ces cuprates réagissent de façon régiosélective en 1, 4 sur les composés carbonylés a, b-insaturés avec une grande stéréosélectivité.
Couplage d'Ullman
La réaction d'Ullman est une réaction de couplage des iodures (ou des bromures) de phényle en présence de cuivre, conduisant à des biaryles symétriques.
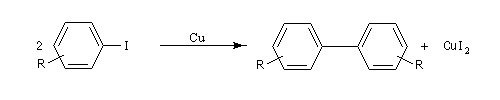
Le mécanisme fait vraisemblablement intervenir une substitution nucléophile aromatique. La réaction est facilitée si le cycle porte un groupe attracteur tel que le groupe nitro. Elle est généralement réalisée à une température voisine de 70 °C.
Du fait de sa limitation à la synthèse des composés symétriques et une température de travail assez élevée, on la remplace de plus en plus par des réactions de couplage croisé utilisant le palladium.
Organozinciques
Préparations
La préparation du premier organozincique, l'iodure d'éthylzinc, par Sir E. Frankland en 1848 marque le début de l'utilisation des composés organométalliques en synthèse organique. On écrivait à l'époque la réaction sous la forme.

En réalité la situation est plus complexe du fait de l'existence du dérivé dialkylé R2Zn.
Les organozinciques sont généralement préparés par une réaction entre le dérivé halogéné et le zinc sous atmosphère inerte (N2, CO2).

Une élévation de la température permet la distillation du dialkylzincique. La réaction marche le mieux lorsque l'halogène est l'iode. Les dérivés bromés sont utilisés avec l'alliage Zn-Cu.
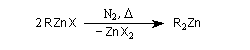
La préparation du diéthylzinc est donnée à la référence [11].
On peut aussi les préparer par réaction entre l'organomagnésien correspondant et ZnCl2 catalysée par le palladium. Les termes les plus simples comme le diéthylzinc sont des liquides dans les conditions ordinaires. Ils sont pyrophoriques et doivent être manipulés sous atmosphère inerte (Ar ou N2) [16].
Structure des zinciques
Contrairement aux réactifs RLi et RMgBr, les dérivés de type R2Zn, ne sont pas naturellement réactifs. Leur structure linéaire les rend non polaires et donc inertes. L'ajout d'un ligand permet de donner à l'organométallique chélaté une structure tétraédrique réactive.
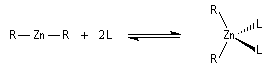
Les organozinciques sont utilisés dans la réaction de Reformatsky.
Le zinc étant fortement réducteur, la réaction entre ce métal et un dérivé halogéné peut conduire à une réaction de réduction. Ainsi la réaction entre le zinc et le chlorure de triphénylméthyle conduit à la formation d'un radical organique relativement stable, le radical triphénylméthyle.
Les organozinciques réagissent avec les dérivés halogénés en présence d'un catalyseur au palladium pour conduire à la réaction de couplage de Negishi.
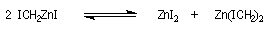
Cyclopropanation
La cyclopropanation des composés éthyléniques peut être effectuée au moyen de la réaction de Simmons-Smith. Le réactif est préparé à partir d'un mélange de CH2I2 et du couple Zn-Cu. La solution est le siège d'un
équilibre du type équilibre de Schlenk.
Le réactif de Simmons-Smith est dit carbénoïde. Le mécanisme exact du transfert du groupe méthylène à partir de ce réactif n'est pas complètement élucidé. La réaction est stéréospécifique de stéréochimie syn.
- le (Z)-but-2-ène donne le produit méso achiral ;
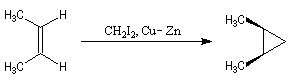
- le (E)-but-2-ène donne le produit like.
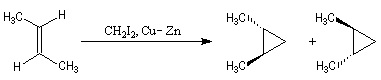
Le mode opératoire de la synthèse du bicyclo[4,1,0]heptane (norcarane) est donné à la référence [14]. Une autre méthode consiste a effectuer l'addition entre
une double liaison éthylénique et un dichlorocarbène puis a effectuer une réduction du dihalogénure obtenu.
Addition énantiosélective des dialkylzinciques
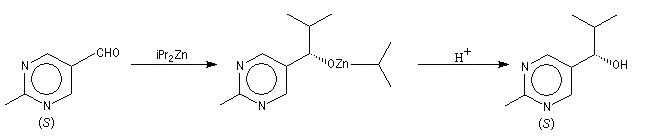
L'addition des dialkylzinciques sur un aldéhyde possédant un carbone prochiral peut être énantiosélective en présence d'un auxilliaire chiral approprié. L'exemple ci-dessous concerne l'addition de diéthylzinc en présence de (-)-3-exo-(diméthylamino)isobornéol ou (-)-DAIB, par R. Noyori [32]. Le mode opératoire
est donné à la référence [13].
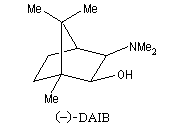
Cet auxilliaire chiral est utilisé avec un excès énantiomérique peu élevé de 15 %.
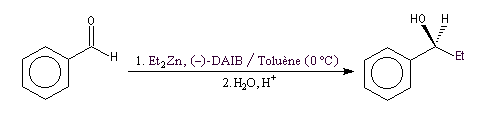
Le (1S)-1-phénylpropan-1-ol est obtenu avec un excès énantiomérique de 98 %. Cette valeur est beaucoup plus élevée que l'excès énantiomérique de l'auxilliaire chiral de départ (15 %). Il s'agit d'un phénomène d'amplification chirale.
Dans l'exemple suivant, le produit chiral sert de catalyseur dans sa propre synthèse. Il s'agit donc d'une autocatalyse. Le premier exemple de ce type a été décrit par Soai [33].
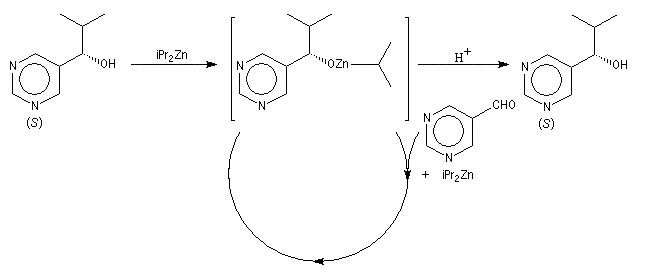
Dans la réaction ci-dessous, 3 mg de substrat présentant un excès énantiomérique de 0, 18 % conduisent à 323 mg de produit avec un excès énantiomérique de 83, 2 %, [34].
Complexes des métaux de transition
Addition oxydante
Considérons deux atomes A et B liés entre-eux par une liaison s et susceptibles de se lier à un complexe MLn selon le schéma suivant :
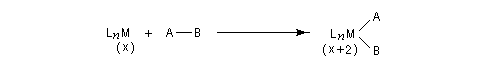
Le nouveau complexe porte deux ligands supplémentaires. L'indice de coordination du métal a donc augmenté. Il s'agit d'une réaction d'addition. Au cours de ce processus, le nombre d'électrons du métal augmente de deux. Le terme oxydation se rapporte au fait que, la plupart du temps, le nombre d'oxydation du métal augmente de deux. Pour qu'un tel schéma soit possible, il faut que le métal puisse accueillir des électrons (donc moins de 18 électrons).
On observe ce type de réaction avec des complexes de degré d'oxydation peu élevé (le métal ne doit en tout cas pas avoir atteint son degré d'oxydation maximal.)
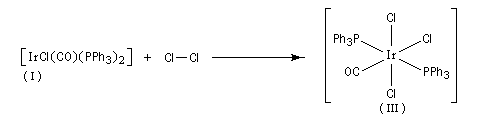
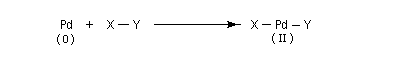
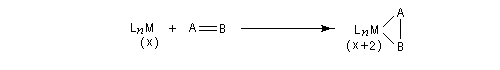
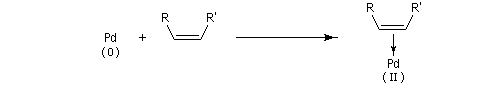
Il est parfois commode de représenter une forme mésomère cyclique de ce type de complexe p
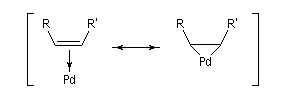
Le couplage oxydant est un cas particulier d'addition oxydante.
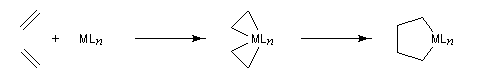
Il existe plusieurs mécanismes connus pour l'addition oxydante :
- mécanisme à trois centres ;
- mécanisme par substitution SN2 ;
- mécanisme ionique ;
- mécanisme radicalaire.
Elimination réductrice
Au cours d'une élimination réductrice, le nombre de coordination du complexe ainsi que le nombre d'oxydation du métal décroissent. Ce processus peut être résumé par l'équation suivante :
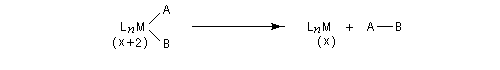
On peut donc regarder ce type de réaction comme l'inverse d'une addition oxydante.
Transmétallation
Il s'agit d'une réaction d'échange d'élément métallique.
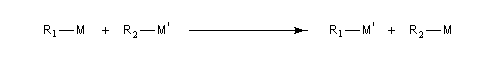
Dans le cas particulier où l'un des groupes R est un halogène. Le métal le plus électropositif se retrouve sous forme d'halogénure.
Exemple : préparation des organocadmiens.
Composés organopalladés
Généralités
Les réactions organiques mettant en jeu le palladium peuvent être schématiquement réparties en deux catégories :
- celles qui font intervenir le Pd (II). Ce sont principalement des oxydations telles que celles mise en jeu dans l'oxydation des composés éthyléniques par le procédé Wäcker. Des composés du Pd (II) sont également utilisés comme catalyseurs dans d'autres réactions. Les composés du Pd (II) les plus utilisés sont PdCl2 et Pd(OAc). Ils sont stables et disponibles dans le commerce.
- les complexes du Pd (0) sont utilisés comme catalyseurs dans plusieurs réactions organiques importantes. Notamment les réactions de couplage permettant la création de nouvelles liaisons carbone-carbone.
Point important à noter : Pd est un métal noble. Aussi le Pd (0) est plus stable que le Pd (II).
Les composés du Pd (II) les plus utilisés sont PdCl2, Pd(OAc). Ce dernier présente l'avantage par rapport au précédent d'être soluble en milieu organique.
Réactions catalysées par des complexes du Pd (0)
Le Pd (0) est souvent obtenu par réduction in situ de composés du Pd (II) par un réducteur tel que PPh3.
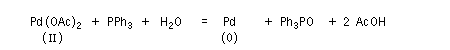
Dans le complexe tris(dibenzylidèneacétone)dipalladium (0), chaque atome de Pd est coordiné avec trois molécules de dba, pour former un complexe à 16 électrons.
Couplages croisés utilisant le palladium
Le Pd (0) est utilisé comme catalyseur dans des réactions de couplage croisé.
Bibliographie
F. A. Carey, R. J. Sunberg - Advanced organic chemistry (Plenum press 1996).
J. March - Advanced Organic Chemistry (J. Wiley 2006).
P. Laszlo - Logique de la synthèse organique - Cours de l'Ecole polytechnique (Ellipses 1993).
Les complexes de palladium en synthèse organique : initiation et guide pratique, J.-M. Campagne, D. Prim, Ed. Lavoisier, 2001.
N. N. Greenwood, A. Earnshaw - Chemistry of the elements (Pergamon Press 1986).
Metal-catalyzed Cross-coupling Reactions, Edited by F. Diederich and P. J. Stang,
Wiley-VCH, New York, 2004
Organometallics in Synthesis. A manual, Schlosser, M., Second Edition, Wiley, New
York, 2002.
Liens
[1] The Nobel Prize in Chemistry 1912
[2] n-Hexaldéhyde by G. Bryant Bachman.
[3] Highly reactive magnesium by R. D. Rieke, S. E. Bales, P. M. Hudnall, T. P. Burns, and G. S. Poindexter.
[4] Cyclohexylcarbinol by Henry Gilman and W. E. Catlin.
[5] Triphenylcarbinol by W. E. Bachmann and H. P. Hetzner.
[6] Manganese copper conjugate addition of Grignard Reagent by S. Marquais, M. Alami, and G. Cahiez.
[7] (Z)-1-iodohexene by A. Alexakis, G. Cahiez, and J. F. Normant.
[8] Di n-butyldivinyletain by Dietmar Seyferth.
[9] Enantioselective addition of butyllithium by D. Seebach and A. Hidber.
[10] (R)-(+)-2-(hydroxymethyl)-pyrrolidine by Nikola A. Nikolic and Peter Beak.
[11] Diethyl-Zinc by C. R. Noller
[12] Copper-Catalysed Conjugated Addition of Functionalized Organozinc Reagents to a, b-Unsaturated Ketones by B. H. Lipshutz, M. R. Wood, and R. Tirado
[13] Catalytic Enantioselective Additions of Dialkyl Zincs to Aldehydes using (2S)-DAIB) by Masato Kitamura, Hiromasa Oka, Seiji Suga, and Ryoji Noyori.
[14] Norcarane by R. D. Smith and H. E. Simmons
[15] Thèse Delacroix
[16] Manipulations sous atmosphère inerte modes opératoires pour la préparation des réactifs organométalliques
[17] Organozinc
[18] Cours P. Sibi.
[19] Structure des cuprates.
[20] New Methods for the Synthesis of Organozinc ans Organocopper Reagents by C. Piazza.
[21] Recent Advances in Organocurate Chemistry Jason S. Tedrow Evans Group, Harvard University.
[22] Réaction de Réformatsky asymétrique par Michel Obringer.
[23] Kumada coupling
[24] Organometallic Hypertext Book by Rob Toreki
[25] La chimie des organomagnésiens en France après Grignard par H. Normant.
Articles
[29] H. Gilman, R. G. Jones and L. A. Woods, J. Org. Chem., 1952, 17, 1630–1634.
[30] Watson, S. C.; Eastham, J. F. J. Organometal. Chem. 1967, 9, 165.
[31] D. O. Cowan, H. S. Mosher, Comparison of the Reactions of Grignard Reagents and Dialkylmagnesium Compounds in Addition, Reduction, and Enolization Reactions - J. Org. Chem., 27, p. 1-5.
[32] R. Noyori et al J. Am. Chem. Soc, 108, 6071, 1986.
[33] K. Soai. Nature 1295, 378, 767.
[34] K. Soai. Tetrahedron : Asymmetry, 1997, 8, 1717.
[35] Kohei Tamao, Koji Sumitani, Makoto Kumada (1972). "Selective carbon-carbon bond formation by cross-coupling of Grignard reagents with organic halides. Catalysis by nickel-phosphine complexes". J. Am. Chem. Soc. 94 (12): 4374–4376. doi:10.1021/ja00767a075.
[36] B.H. Lipschutz, R.S. Wilhelm et D.M. Floyd, J. Am. Chem. Soc., 103 (1981) 7672.
[37] Kochi, J., Synthesis 1971, 303.
[38] J. -P. Foulon - Dosage des organomagnésiens et des lithiens. Bulletin de l'union des physiciens 629, décembre 1980.
[39] G. Dupuis - La découverte du radical triphénylméthyle par Moses Gomberg. Bulletin de l'Union des Physiciens, janvier 2002.
Pour aller plus loin
Synthèse organique par voie organométallique par T. Ollevier
Organometallic compound of Lithium Sodium and Potassium by Michael K. Denk
Organometallic chemistry by Worawan Bhanthumnavin
The basic chemistry of organopalladium compounds
RETOUR AU MENU DU COURS
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial.
Texte, photographies Gérard Dupuis - Lycée Faidherbe - LILLE
février 2014