|
|
|
Autre version : Version CHIME
Qu'est ce que la frontaline ?
La frontaline, isolée pour la première fois par G. Kinzer [1], joue un rôle important dans la communication chimique chez certains insectes. C'est une phéromone d'agrégation de population de certains coléoptères appartenant à la famille des scolitidae :Dendroctonus adjunctus Blandford ; Dendroctonus brevicomis ; Dendroctonus frontalis Zimmermann ; Dendroctonus ponderosae Hopkins ;
Dendroctonus pseudotsugae Hopkins ; Dendroctonus terebrans (Olivier).
Parmi ces insectes, le scarabée Dendroctonus frontalis Zimmermann encore appelé Southern Pine Beetle (SPB) est l'insecte le plus destructeur des
forêts de pins dans le sud des USA.
|
|
|
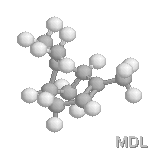
Molécule de frontaline
La frontaline est un composé bicyclique possèdant la fonctionnalité acétal.
|
|
Le (1S,5R)-diméthyl-1,5-dioxa-6,8-bicyclo[3,2,1]octane ou (-)-frontaline |
|
|
Aspect biologique : mécanisme de la colonisation
Attaque initiale
Le mécanisme d'agrégation des insectes n'est pas parfaitement connu mais il semble que les essences
volatiles émises par les arbres attirent quelques insectes pionniers femelles. Le constituant majoritaire de ces essences est un monoterpène : l'a-pinène. Les femelles secrètent alors un mélange de (-)-frontaline, de trans-verbénol et de verbénone qui provoque le rassemblement
d'une grande quantité d'insectes mâles et femelles. Le trans-verbénol et la verbénone ont pour effet d'exalter le caractère attracteur de la frontaline.
Attaque en masse
Durant cette phase qui dure entre trois et cinq jours après l'attaque initiale, mâles et femelles se reproduisent tout en continuant à produire
de la frontaline, du trans-verbénol et de la verbénone. A partir d'un certain seuil de concentration ces deux dernière substances jouent le rôle d'inhibiteurs de la frontaline ce qui
a tendance à ralentir puis stopper le phénomène d'agrégation.
 |
 |
 |
 |
|
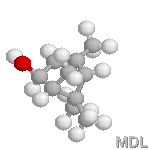
a-Pinène |
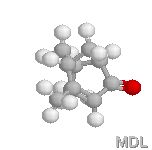
trans-Verbénol |
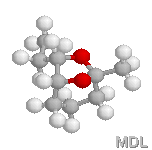
Verbénone |
endo-Brevicomine |
Le schéma complet de la biosynthèse de la frontaline n'est pas connu actuellement. Une voie possible
est la transformation de composé isoprénoides régulée par une enzyme HMG-CoA reductase (HMG-R).
L'intérêt porté depuis plusieurs années aux médiateurs chimiques que sont les phéromones et la difficulté à isoler ces composés à l'état naturel, ont poussé plusieurs
équipes à en réaliser la synthèse. Les statégies développées ont d'abord porté sur la synthèse du racémique puis
plus récemment sur la synthèse énantiosélective de la (-)-frontaline.
Analyse rétrosynthétique
La molécule contient une fonction acétal. Son ouverture définit le composé (T) comme précurseur. Ce dernier possède un groupe carbonyle, une fonction alcool primaire et une fonction alcool tertiaire.
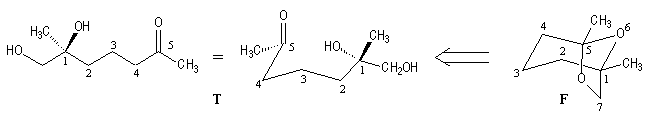
Alors que la frontaline possède deux atomes de carbone asymétriques de configurations absolues 1S et 5R, son précurseur (T) n'en contient qu'un seul : l'atome C1 de configuration absolue S. La configuration absolue de l'atome de carbone C5 est détermninée par la possibilité de fermeture du système tricyclique. Elle est alors nécessairement R.
Synthèses de la frontaline racémique
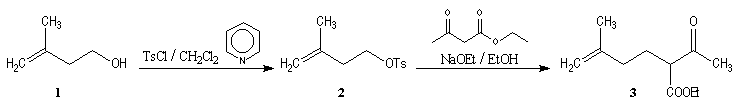
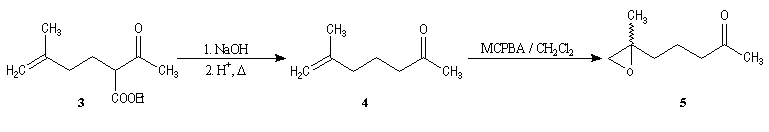
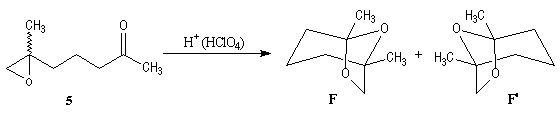
Synthèses énantiosélectives de la (-)-frontaline
Plusieurs synthèses énantiosélectives de la (-)-frontaline ont été publiées. Nous en donnerons trois qui illustrent quelques méthodes classiques utilisées en synthèse asymétrique.
M. C. Trinth, J-C Florent, C. Monneret [4] ; [5] partent d'un dérivé chiral du lactose comme substrat de départ.
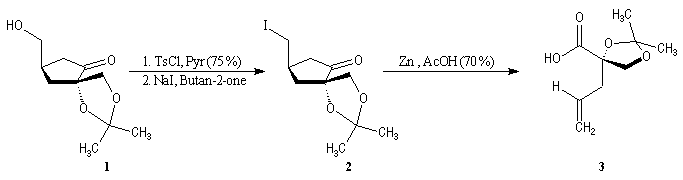
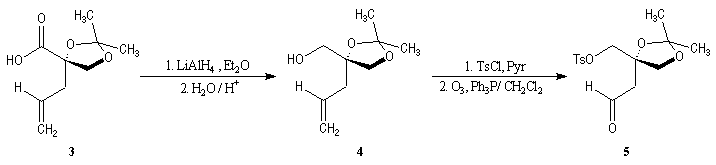
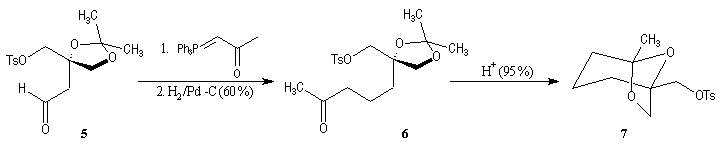
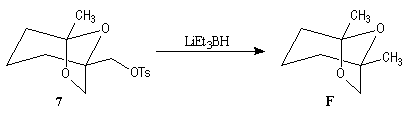
La première étape est la préparation d'une a-siloxycétone chirale. (2).
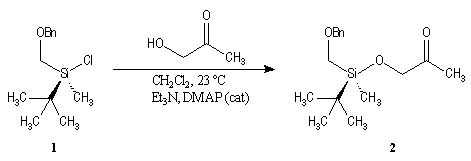
L'induction asymétrique sous l'influence du groupe (tert-butyl)(méthyl)(benzyloxyméthyl)silyle n'est pas très élevée. Cependant l'addition du réactif de Grignard G s'effectue de façon préférentielle sur la face prochirale la moins encombrée de l'a-siloxycétone (2). Les alcools 3 et 3' sont obtenus avec une diastéréosélectivité moyenne dans les proportions : 60/40. Le composé 3, qui possède la stéréochimie requise, est ensuite converti en (-)-frontaline F.
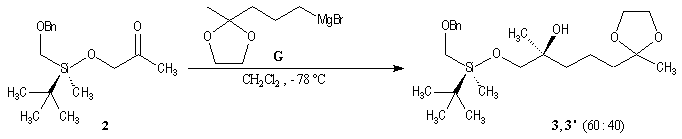
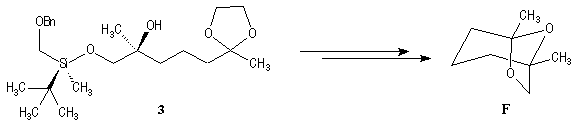
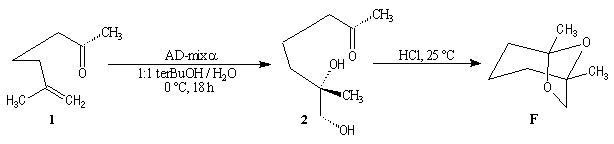
Cette méthode fournit la (-)-frontaline avec des excès énantiomériques compris entre 60 et 70 %.
Références bibliographiques
[1] G. W. Kinzer; A. F. Fentiman T. F. Page; R. L. Foltz; J. P. Vite; G. B. Pitman Nature 1969, 221, 447.Liens
Synthèses
[9] Synthesis of frontalin using a Chiral Silyl Ether
[10] TP Université de Liège
[11] Frontalin Project Home Page
Biosynthèse
Biosynthesis of frontalin in the Jeffrey Pine Beetle
Biosynthesis of bark beetle aggregation pheromones
Enzymatic and microbial hydrolyse of epoxydes
Asymmetric hydrolysis of epoxydes
Aspects biologiques
Attractive and inhibitory pheromones produced in the bark beetle Dendroctonus Brevicomis
Chemical ecology of the Southern Pine Beetle
SPB Update. Utilisation de la verbenone
The Southern Pine Beetle
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial
Gérard Dupuis - Lycée Faidherbe LILLE
gdupuis-prof@faidherbe.org
décembre 2000